Química, na vida cotidiana, é raro depararmos com substâncias puras. Em sua maioria, encontramos misturas que contêm dois ou mais componentes puros. Assim, a utilidade ou importância dessas misturas na vida quotidiana depende da sua composição.
Por exemplo, as propriedades químicas do latão (uma mistura de cobre e zinco) diferem significativamente daquelas da “prata alemã” (uma combinação de cobre, zinco e níquel) ou do bronze (uma mistura de cobre e estanho). A presença de íons fluoreto na água exemplifica bem essa parte da química: 1 parte por milhão (ppm) desses íons previne a cárie dentária, enquanto 1,5 ppm resulta em manchas nos dentes; concentrações elevadas de íons de flúor podem ser tóxicas (como no fluoreto de sódio, utilizado como veneno para ratos). No caso de injeções intravenosas, os profissionais sempre dissolvem essas injeções em água contendo sais, especialmente em concentrações iônicas que correspondam às do plasma sanguíneo, e assim por diante.
Consideraremos principalmente líquido como soluções e sua formação. Dessa maneira, isto seguido pelo estudo das propriedades das soluções, como a pressão de vapor e as propriedades coligativas. Para iniciar, vamos abordar os tipos de soluções e, em seguida, discutir várias alternativas para expressar as concentrações de um soluto em uma solução líquida.
Tipos de soluções químicas
Soluções são misturas homogêneas de dois ou mais de dois componentes. Por mistura homogênea, entendemos que sua composição química e as propriedades são uniformes em toda a mistura. Geralmente, o componente presente em maior quantidade é conhecido como solvente. Este determina o estado físico em que a solução existe. Um ou mais componentes presentes na solução, além do solvente, chamados solutos.
Vamos considerar apenas soluções binárias, ou seja, duas componentes, mas lembre-se de que elas formadas por mais componentes na química.
- Soluções Gasosas:
- Gás – Gás: Ou seja, tanto o soluto, quanto o solvente são gases, um exemplo é a mistura de oxigênio e nitrogênio para formar o NO;
- Líquido – Gás: Soluto sendo um líquido e o solvente um gás, mistura de clorofórmio com gás nitrogênio;
- Sólido – Gás: Onde o soluto será um sólido e o solvente um gás, um exemplo clássico é a cânfora em gás nitrogênio
- Soluções líquidas:
- Gás – Líquido: Sabe-se que a fórmula molecular da água é H2O, entretanto o peixe respira o O2 dissolvido na água, e não o oxigênio molecular da água.
- Sólido – Líquido: Sacaroso solubilizada em água (ou seja, uma água com açucar);
- Líquido – Líquido: Um bom exemplo etanol dissolvido em água para obtermos o famoso álcool 70 (70%, ou seja, um mistura de 7:1 de etanol:água).
- Soluções de sólido:
- Gás – Sólido: Solução de Hidrogênio em Paládio;
- Líquido – Sólido: Uma amálgama de mercúrio com sódio (antigamente usado por dentistas para tirar moldes dos dentes);
- Sólido – Sólido: Prata ou cobre dissolvida em ouro, os famosos (ouro 18 quilates);
Concentração de uma solução química</h2>
A composição de uma solução, descrita expressando sua concentração. Este último pode ser expresso qualitativamente ou quantitativamente. Por exemplo, qualitativamente podemos dizer que a solução diluída (ou seja, contém uma quantidade relativamente pequena de soluto) ou está concentrada (ou seja, contém uma quantidade relativamente grande de soluto). No entanto, na vida real, esses tipos de descrição podem gerar muita confusão e, portanto, há a necessidade de uma descrição quantitativa da solução.
Existem várias maneiras pelas quais podemos descrever a concentração da solução de forma quantitativa.
Porcentagem em Massa (m/m)
A porcentagem em massa de um componente de uma solução é definida como:
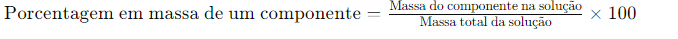
Por exemplo, se uma solução é descrita como 10% de glicose em água em massa, significa que 10 g de glicose estão dissolvidos em 90 g de água, resultando em uma solução de 100 g. Assim, a concentração descrita pela porcentagem em massa é comumente usada em aplicações químicas industriais. Outro exemplo, uma solução comercial de alvejante contém 3,62% em massa de hipoclorito de sódio em água.
Porcentagem em Volume (v/v)
Porcentagem em volume (V/V): A porcentagem em volume é definida como:
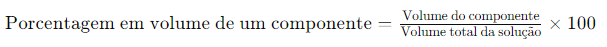
Por exemplo, uma solução de 10% de etanol em água significa que 10 mL de etanol estão dissolvidos em água, de modo que o volume total da solução é 100 mL. Na química, soluções contendo líquidos são comumente expressas nesta unidade. Um outro exemplo uma solução de 35% (v/v) de etilenoglicol, um anticongelante, é usada em carros para resfriar o motor. Nesta concentração, o anticongelante reduz o ponto de congelamento da água para 255.4K (-17.6°C).
Qual a relação entre a química e a Porcentagem Massa em Volume (m/v)
É uma das unidades mais comumente usada em medicina e farmácia é a porcentagem massa por volume. É a massa do soluto dissolvido em 100 mL da solução.
Partes por milhão (ppm)
Quando um soluto está presente em quantidades traço (muito, muito pequeno e que em escala normal seria zero), é conveniente expressar a concentração em partes por milhão (ppm) e é definida como:
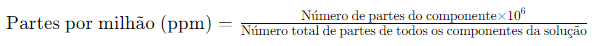
Assim como no caso da porcentagem, a concentração em partes por milhão também pode ser expressa como massa por massa, volume por volume e massa por volume. Um litro de água do mar (que pesa 1030 g) contém cerca de 6×10−3 g de oxigênio dissolvido (O₂). Uma concentração tão pequena também é expressa como 5,8 g por 106 g (5,8 ppm) de água do mar. A concentração de poluentes na água ou na atmosfera é frequentemente expressa em termos de mg*mL⁻¹ ou ppm.
Fração Molar e química
O símbolo comumente usado para a fração molar é 𝑥, e o subscrito usado no lado direito de 𝑥denota o componente.
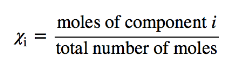
Por exemplo, em uma mistura binária, se o número de moles de A e B forem nA e nB, respectivamente, a fração molar de A será
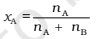
Para uma solução contendo i número de componentes, temos:
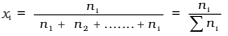
Pode demonstrar que em uma solução dada, a soma de todas as frações molares é igual a um, ou seja,
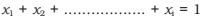
A unidade de fração molar é muito útil para relacionar algumas propriedades físicas das soluções, como a pressão de vapor com a concentração da solução, e é bastante útil na descrição de cálculos envolvendo misturas gasosas.
Molaridade e soluções químicas
A molaridade (M), definida como o número de moles de soluto dissolvido em um litro (ou um decímetro cúbico) de solução:

Por exemplo, uma solução de 0,25 mol L⁻¹ (ou 0,25 M) de NaOH significa que 0,25 mol de NaOH foram dissolvidos em um litro (ou um decímetro cúbico).





