Hoje quero que você descubra o segredo do porque a Qúmica é uma das disciplinas mais complexas do ENEM e como você poderá descomplica-la neste post.
A Química, juntamente com a Biologia e a Física, constitui a essência da área de Ciências da Natureza e suas Tecnologias. Sendo assim, ao todo, são 45 questões, no ENEM, distribuídas entre essas três disciplinas, que são aplicadas no segundo dia de prova, acompanhadas por Matemática e suas Tecnologias.
Porém, os ramos da Química mais intensamente abordados no Enem compreendem: Química Geral, Físico-química, Química Orgânica e Química Ambiental. Contudo, os enunciados das questões são estrategicamente contextualizados, proporcionando uma interligação significativa entre as diversas áreas do conhecimento e temas do cotidiano. Além disso, é crucial praticar constantemente por meio de exercícios e simulados para consolidar o conhecimento adquirido. E por fim, o ENEM é uma prova com bastante leitura e interpretação de texto, então se mantenha afiado nesse quesito (não só par ao ENEM, mas para a vida).
Agora te convido a resolver algumas questões.
Portanto, vamos lá?
Descubra o segredo respondendo a Questão 01 sobre química
(Enem-2018) O grafeno é uma forma alotrópica do carbono constituído por uma folha planar (arranjo bidimensional) de átomos de carbono compactados e com a espessura de apenas um átomo. Sua estrutura é hexagonal, conforme a figura.
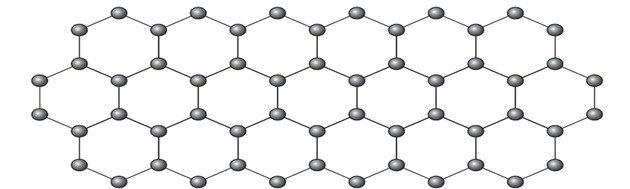
Nesse arranjo, os átomos de carbono possuem hibridação
a) sp de geometria linear.
b) sp2 de geometria trigonal planar.
c) sp3 alternados com carbonos com hibridação sp de geometria linear.
d) sp3d de geometria planar.
e) sp3d2 com geometria hexagonal planar.Ver Resposta
Resposta:
Alternativa correta: b) sp2 de geometria trigonal planar.
Tentarei fazer um resumo, mas caso queira uma abordagem um pouco mais aprofundada, porém “entendível”, sugiro o capítulo I do Solomons. Assim, a alotropia do carbono se manifesta devido à sua habilidade única de formar diversas substâncias simples. Dessa maneira, com seus 4 elétrons na camada de valência, o carbono se revela tetravalente, o que implica em sua propensão para realizar até 4 ligações covalentes, podendo variar entre simples, duplas ou triplas.
A estrutura espacial da molécula é alterada de acordo com as ligações que o carbono estabelece, adaptando-se ao arranjo que melhor acomoda os átomos. Dessa maneira, a hibridação entra em cena quando ocorre a combinação de orbitais, e para o carbono, essa hibridação pode assumir diferentes formas, como sp, sp2 e sp3, dependendo do tipo de ligações presentes. Esse fenômeno influencia diretamente nas propriedades e características das substâncias carbonadas.
Descubra o segredo por trás da Hibridação
O número de orbitais híbridos é, de fato, determinado pela soma das ligações sigma (σ) que o carbono realiza, uma vez que a ligação pi não passa pelo processo de hibridização.
Para esclarecer:
- hibridação sp: envolve 2 ligações sigma.
- hibridação sp2: envolve 3 ligações sigma.
- hibridação sp3: envolve 4 ligações sigma.
Ao analisar a representação do alótropo grafeno em bolas e varetas, conforme a figura da questão, é importante notar que essa representação não ilustra as verdadeiras ligações da substância.
Contudo, ao examinar uma parte específica da imagem, observa-se que um carbono, representado por uma bola, está ligado a outros três carbonos, formando uma estrutura triangular. Se o carbono precisa de 4 ligações e está ligado a outros 3 carbonos, então conclui-se que uma dessas ligações é dupla.
Assim, devido à presença de uma ligação dupla e duas ligações simples, o grafeno exibe hibridação sp2 e, consequentemente, uma geometria trigonal planar. Além do grafeno, outras formas alotrópicas do carbono incluem grafite, diamante, fulereno e nanotubo. Embora todos sejam compostos de carbono, esses alótropos exibem propriedades distintas, derivadas de suas diferentes estruturas, evidenciando a riqueza das manifestações do carbono na natureza.
Questão 2
(Enem-2018) Em 1938 o arqueólogo alemão Wilhelm König, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado. Considere os potenciais-padrão de redução:

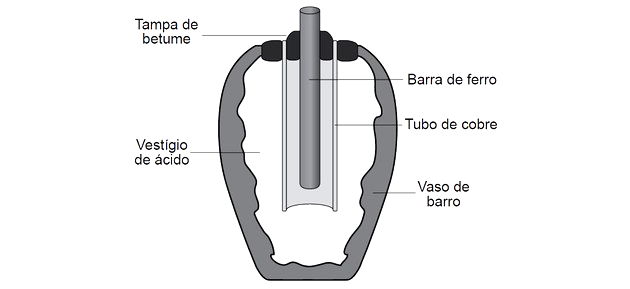
Entretanto, nessa suposta pilha, qual dos componentes atuaria como cátodo?
a) A tampa de betume.
b) O vestígio de ácido.
c) A barra de ferro.
d) O tubo de cobre.
e) O vaso de barro.
Resposta:
Alternativa correta: d) O tubo de cobre.
Primeiramente, uma pilha é um dispositivo que converte energia química em elétrica por meio de reações espontâneas. Essa forma de energia química surge de reações de oxirredução, onde há a transferência de elétrons. O fluxo de elétrons acontece quando uma substância é oxidada, liberando elétrons, enquanto outra substância é reduzida, recebendo esses elétrons.
Sendo assim, a reação de oxirredução destacada neste contexto é a corrosão:, ou seja, uma barra de ferro que foi aparentemente corroída por ácido. Porém, neste processo, a barra de ferro sofre oxidação, cedendo elétrons ao ácido, que, por sua vez, sofre redução, recebendo esses elétrons.
Podemos identificar os componentes principais:
- Ânodo: polo negativo da pilha, onde ocorre a oxidação e a emissão de elétrons.
- Cátodo: polo positivo da pilha, onde ocorre a redução e a recepção de elétrons.
Os potenciais-padrão de redução, fornecidos na questão, indicam a propensão das substâncias à redução. No caso, o cobre tem um potencial maior do que o ferro, o que significa que o cobre tem maior tendência a receber elétrons, agindo como o cátodo. O ácido, próximo ao cobre, recebe os elétrons provenientes do ferro. Dessa maneira, ao ocorrer a transferência de elétrons, uma pilha é formada espontaneamente.
Questão 3
(Enem-2018) Por meio de reações químicas que envolvem carboidratos, lipídeos e proteínas, nossas células obtêm energia e produzem gás carbônico e água. A oxidação da glicose no organismo humano libera energia, conforme ilustra a equação química, sendo que aproximadamente 40% dela é disponibilizada para atividade muscular.
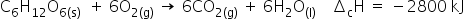
Considere as massas molares em (em g mol-1):
LIMA, L.M.; FRAGA, C.A.M; BARREIRO, E.J. Química na saúde. São Paulo: Sociedade Brasileira de Química, 2010 (adaptado).
Na oxidação de 1,0 grama de glicose, a energia obtida para atividade muscular, em quilojoule, é mais próxima de
a) 6,2.
b) 15,6.
c) 70,0.
d) 622,2.
e) 1120,0.
Resposta:
Alternativa correta: a) 6,2.
A quantidade de energia envolvida em uma reação depende das proporções entre os reagentes e produtos que participam do processo.
Assim, ao analisar a equação química fornecida, que descreve a transformação de 1 mol de glicose (C6H12O6) e 6 mols de oxigênio (O2) em 6 mols de dióxido de carbono (CO2) e 6 mols de água (H2O), observamos uma liberação de 2800 kJ. Em outras palavras, a reação libera 2800 kJ quando essas quantidades molares específicas estão envolvidas.
A variação de entalpia pode ser associada a qualquer componente da reação, desde que a equação esteja devidamente balanceada.
Portanto, para relacionar 1 g de glicose com a energia liberada, iniciamos calculando a massa molar da glicose:
- Carbono (MM = 12 g/mol): 6 x 12 = 72 g/mol
- Hidrogênio (MM = 1 g/mol): 12 x 1 = 12 g/mol
- Oxigênio (MM = 16 g/mol): 6 x 16 = 96 g/mol
A massa molar da glicose (C6H12O6) é então a soma desses valores, resultando em 180 g/mol. Utilizando essa massa correspondente a 1 mol, calculamos que a energia liberada em 1 g de glicose é aproximadamente 15,6 kJ.
Observando a questão referente à energia utilizada para atividade muscular, consideramos que a energia calculada anteriormente representa o valor total. Para encontrar a energia correspondente a 40% desse total, calculamos que a energia para a atividade muscular seria aproximadamente 6,2 kJ.
Questão 4
(Enem-2018) As abelhas utilizam a sinalização química para distinguir a abelha rainha de uma operária, sendo capazes de reconhecer diferenças entre moléculas. A rainha produz o sinalizador químico conhecido como ácido 9-hidroxidec-2-enoico, enquanto as abelhas operárias produzem o ácido 10-hidroxidec-2-enoico. Nós podemos distinguir as abelhas operárias e rainhas por sua aparência, mas, entre si, elas usam essa sinalização química para perceber a diferença. Pode-se dizer que veem por meio da química.
LE COUTEUR, P.; BURRESON, J. Os botões de Napoleão: as 17 moléculas que mudaram a história. Rio de Janeiro: Jorge Zahar, 2006 (adaptado).
As moléculas dos sinalizadores químicos produzidas pelas abelhas rainha e operária possuem diferença na
a) fórmula estrutural.
b) fórmula molecular.
c) identificação dos tipos de ligação.
d) contagem do número de carbonos.
e) identificação dos grupos funcionais.
Descubra o segredo através da seguinte resposta:
Alternativa correta: a) fórmula estrutural.
Ao analisar os nomes dos compostos, podemos identificar as seguintes características:
- 9-hidroxidec-2-enoico: Com efeito, refere-se a um composto com 10 carbonos, apresentando uma ligação dupla no carbono 2, e termina com a terminação “oico” indicando a presença de um ácido carboxílico. A hidroxila (OH) está localizada no carbono 9.
- 10-hidroxidec-2-enoico: Contudo, ela também se trata de um composto com 10 carbonos, uma ligação dupla no carbono 2, e termina com a terminação “oico” indicando a presença de um ácido carboxílico. A diferença é que a hidroxila (OH) está agora localizada no carbono 10.
Ao desenhar as estruturas dos compostos, percebemos que ambos possuem semelhanças e diferenças notáveis. Ambos compartilham:
- O mesmo número de carbonos (10).
- O mesmo tipo de ligação (ligação covalente).
- Os mesmos grupos funcionais, incluindo álcool (OH) e ácido carboxílico (COOH).
- A mesma fórmula molecular, que é C10H18O3.
A distinção crítica entre esses dois compostos reside na posição da hidroxila (OH), que está no carbono 9 para o primeiro composto e no carbono 10 para o segundo. Portanto, esses compostos são considerados isômeros estruturais, indicando que embora compartilhem a mesma fórmula molecular, suas estruturas moleculares são diferentes devido à variação na disposição dos átomos.
Em suma, essa diferença estrutural é significativa e tem implicações práticas, como na sinalização química entre abelhas rainhas e operárias, destacando a sensibilidade desses organismos a pequenas alterações na estrutura molecular.
Agora que você chegou até aqui, quero que descubra o segredo sobre os resíduos tóxicos na Questão 5
(Enem-2018) Companhias que fabricam jeans usam cloro para o clareamento, seguido de lavagem. Algumas estão substituindo o cloro por substâncias ambientalmente mais seguras como peróxidos, que podem ser degradados por enzimas chamadas peroxidases. Pensando nisso, pesquisadores inseriram genes codificadores de peroxidases em leveduras cultivadas nas condições de clareamento e lavagem dos jeans e selecionaram as sobreviventes para produção dessas enzimas.
TORTORA, G.J.; FUNKE, B.R.; CASE, C.L. Microbiologia. Rio de Janeiro: Artmed, 2016 (adaptado).
Logo, o uso dessas leveduras modificadas objetiva
a) reduzir a quantidade de resíduos tóxicos nos efluentes da lavagem.
b) eliminar a necessidade de tratamento da água consumida.
c) elevar a capacidade de clareamento dos jeans.
d) aumentar a resistência do jeans a peróxidos.
e) associar ação bactericida ao clareamento.
Resposta:
Alternativa correta: a) reduzir a quantidade de resíduos tóxicos nos efluentes da lavagem.
Com efeito, ressalta-se que o cloro é amplamente utilizado na indústria como branqueador devido à sua eficiência e custo relativamente baixo. No entanto, a formação de compostos organoclorados nos efluentes industriais, resultantes do contato dos íons de cloro com matéria orgânica, tem levado à busca de novas alternativas.
Essas alternativas visam superar os desafios associados à presença de compostos organoclorados nos efluentes, uma vez que sua acumulação pode ter efeitos tóxicos significativos.
Entretanto, agora quero que você:
- Descubra o segredo sobre os danos às plantas: Com efeito, o acúmulo de íons de cloro, transportados pela água, pode causar queimaduras nas folhas das plantas, impactando negativamente a vegetação circundante.
- Geração de mutagenicidade: Assim, os efluentes contendo altas concentrações de cloro podem se tornar geradores de mutagenicidade, representando uma preocupação para o meio ambiente e a saúde pública.
A substituição do cloro por peróxidos apresenta vantagens significativas, uma vez que os peróxidos são degradados por enzimas. Portanto, isso resulta em uma redução na quantidade de resíduos tóxicos nos efluentes de lavagem, contribuindo para práticas mais sustentáveis.
Todavia, é importante notar que, mesmo ao optar pelo uso de peróxidos, outros compostos químicos e microrganismos podem ainda estar presentes nos efluentes.
Portanto, a utilização de peroxidases não elimina a necessidade de um tratamento abrangente da água para garantir a remoção eficaz de diversos poluentes e substâncias indesejadas. Dessa maneira, o foco na degradação enzimática oferece uma abordagem mais amigável ao meio ambiente e pode ser parte integrante de estratégias mais sustentáveis para o tratamento de efluentes industriais.





